6月6日消息,美國時間6月5日,金斯瑞生物科技子公司傳奇生物赴美國納斯達克上市交易,股票代碼“LEGN”,發行價為23美元/股,預計總募資金額為4.24億美元。上市首日,傳奇生物開報37美元/股。截至發稿,其市值一度達47億美元以上,后小幅回調。此前,IPO條款發布后,按照提議的定價區間的中點,傳奇生物的市值約26億美元。
傳奇生物成立于2014年11月,是一家進入臨床階段的生物制藥公司,致力于發現和開發血液/腫瘤、感染性疾病和自身免疫疾病的新型細胞治療。2017年和2018年,傳奇生物憑借在CAR-T領域的突破性進展一戰成名,2018年更是斬獲了國內首個CAR-T臨床批件。
在腫瘤學的百余年發展過程中, CAR-T療法所在的免疫療法已經是繼化療和靶向治療后的第三次革命性突破。CAR-T療法最早由Gross等于上世紀80年末提出,至今已有30余年的發展歷程。
2017年,是CAR-T療法發展過程中值得銘記的一年。這一年,FDA批準了首款CAR-T療法產品——諾華研發的Kymriah。僅僅兩個月后,Kite Pharma的Yescarta也在美國獲批上市。兩款產品的上市,掀起了隨后的研發熱潮。
2020年,行業里暗流涌動。吉利德科學旗下Kite公司和Teneobio公司聯合宣布,雙方合作開發新一代具有雙重靶向的CAR-T療法。科濟生物則宣布完成全球首個靶向GPC3的CAR-T細胞治療晚期肝細胞癌患者的I期臨床試驗。金斯瑞生物將其細胞治療業務剝離,推動傳奇生物在納斯達克敲鐘。
目前,國內尚未有CAR-T產品獲批。走在前列的傳奇生物上市,又將如何攪動一江春水?
選中“冷門”靶點,初闖CAR-T江湖
傳奇生物是CRO企業金斯瑞旗下專攻CAR-T細胞免疫療法的跨國子公司。彼時,隨著免疫療法日漸火熱,CAR-T療法也開始被科學家們所關注,金斯瑞生物同樣看到了該療法的潛力。
通俗地講,CAR-T治療就是抽取病人的T細胞,然后進行改造,使T細胞可以識別并殺死癌細胞。然后在體外繁殖,在把改造后的T細胞注射進患者體內。
2014年,金斯瑞創立的傳奇生物開始投身CAR-T研究,并聘請了當時在免疫治療領域的關鍵意見領袖(KOL)范曉虎博士作為該公司的首席科學官。
當時,中國多發性骨髓瘤近年呈現明顯增長趨勢,每年患病者達到數萬人。在臨床治療中,多發性骨髓瘤是公認難啃的硬骨頭。金斯瑞CEO章方良和范曉虎決定將這一疾病作為攻克對象。
對于研發針對多發性骨髓瘤的藥物而言,其潛在的靶點至少有11種。但在傳奇生物選擇攻克BCMA這一靶點時,還幾乎看不到一家企業在開發相同靶點的產品。
依托金斯瑞的雙特異性抗體平臺,傳奇生物的研發團隊利用了納米抗體的特點,將探尋BCMA這一想法應用到了CAR-T上,隨即發現可以同時靶向兩個不同的結合位點,形成合力。
經過多年研發,傳奇生物誕生了主要候選產品LCAR-B38M/JNJ-4528,為靶向B細胞成熟抗原(BCMA)結構獨特的研究性CAR-T細胞治療,它包括多發性骨髓瘤在內的許多血液系統惡性腫瘤中高表達的蛋白質。
日后的事實證明,最初選中的靶點為其事先布局打下了良好基礎。很快,藍鳥(Bluebird)的產品bb2121也開始在這個蠻荒的江湖上有了名聲。傳奇生物和藍鳥開始齊頭并進,成為了日后BCMA-CAR-T療法領域走得最遠的兩家。
ASCO上的“交鋒”,傳奇生物一戰成名
2017年,美國臨床腫瘤學會年會(ASCO)上,CAR-T療法備受矚目——兩種新的嵌合抗原受體T細胞(CAR-T)治療方法在多發性骨髓瘤患者中呈現出驚人的早期療效。并且這兩種CAR-T療法都是針對同一個蛋白,b細胞成熟抗原(BCMA)。
毫無疑問,這兩種療法來自兩匹黑馬傳奇生物和藍鳥。報告顯示,有35名復發性難治性多發性骨髓瘤(Multiple Myeloma, 簡稱MM)患者接受了傳奇生物JNJ-4528的治療。兩個月后,33名患者出現了臨床緩解的現象(定義為完全反應或是非常好的部分反應)。總體的客觀反應率高達100%。
接受CAR-T療法后的一個普遍反應便是細胞因子釋放綜合癥,這個癥狀有時會危及生命。在接受LCAR-B2M的治療過程中,10名患者中便有8名出現了細胞因子釋放綜合癥,但是大部分都是暫時性的,或是較輕的1級或2級。
而藍鳥在ASCO大會上報告的數據顯示,接受3種不同劑量bb2121治療的15名患者全部出現了客觀反應,其中有4名患者達到了完全反應。還有3名患者接受了第四種較低的bb2121劑量治療,結果全部不治。如果將這3名患者也計入其中,bb2121的整體反應率為89%。
目前,CAR-T療法尚處于初期發展階段,對比分析仍為時過早,但不可否認的是,在CAR-T療法領域,BCMA多發性骨髓瘤將是可預見的發力點。
也是這一年年底,傳奇生物因為CAR-T產品獲得了強生集團旗下楊森公司的青睞,雙方達成全球合作,共同開發和推廣該藥物治療多發性骨髓瘤患者。一年后,傳奇生物斬獲了國內首個CAR-T臨床批件。
自此,JNJ-4528的研究進展也開始層層推進。在獲得FDA授予的孤兒藥資格,以及歐盟EMA授予的PRIME藥品認定后,2019年12月,楊森公司宣布,美國FDA授予該公司靶向B細胞抗原(BCMA)的CAR-T療法JNJ-4528突破性療法認定,用于治療經治多發性骨髓瘤患者。突破性療法認定將加快這一創新療法的開發和審評過程。
目前,全球正在注冊開展的CAR-T臨床試驗主要在中美兩國,大多處于臨床前期和臨床1-2期。據市場調研機構Coherent Market Insights此前統計,2018年至2028年,全球CAR-T細胞免疫治療市場的平均年復合增長率將達46.1%,其中北美和歐洲依舊是兩大主要市場。
不過,在當下的CAR-T制藥發展領域上,仍有不少需要應對的風險。除了臨床上普遍會產生的細胞因子風暴,還有一個發展瓶頸便是細胞產品的制備CMC。在制備CMC上,就連BMS也未能做到令人滿意。在2020年的ASCO會前,BMS原本要著重“宣傳”的產品便因數據問題而被FDA拒批。
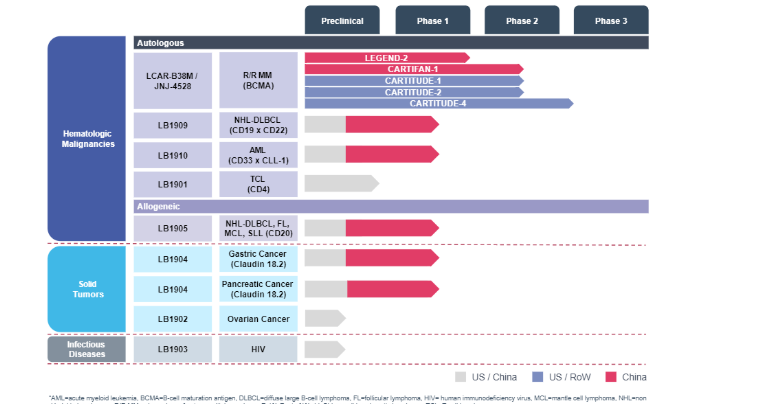
目前,JNJ-4528的Ⅱ期驗證性試驗仍于中國進行中。除了JNJ-4528,傳奇生物在細胞治療領域也布局了多條管線,針對非霍奇金淋巴瘤NHL、急性髓細胞性白血病AML、以及治療NHL的靶點為CD20同種異體CAR-T候選藥物等。
傳奇生物研發管線.png
傳奇生物研發管線。圖源:傳奇生物官網
這些管線均為處于臨床早期的自體候選組合,其中進展最快的產品仍是JNJ-4528。傳奇生物預計于2020年下半年向FDA提交JNJ-4528適用于R/RMM治療的BLA(生物制品許可申請),并準備推動其在歐洲、中國、日本獲批上市。
由于還未有產品上市,傳奇生物的收入主要來自與楊森的合約收益。2019年年報顯示,報告期內,傳奇生物實現營收5726.4萬美元,同比增長16.5%,收入包括確認根據協議收到的預付款和里程碑付款。截至目前,楊森向傳奇生物支付了3.5億美元的預付費用和總計1.1億美元的里程碑付款。

